고분자는 고분자를 이루는 chain의 배열상태에 따라 두 가지로 나눌 수 있다. 무작위적으로 배열된 chian 영역을 amorphous polymer라고 하고, 규칙적으로 쌓아올려진 영역을 crystalline polymer 이라고 한다. 대부분의 고분자는 100% amorphous 하거나 crystalline 하지 않고, 두 영역이 혼합된 semi crystalline 배열을 하고 있다.

긴 사슬을 갖는 고분자는 가열하면 특성이 변화하게 된다. 낮은 온도에서는 glass 상태지만 온도가 올라가면 rubber 상태로 변화하게 된다. 이 상전이가 일어나는 온도를 Tg(glass transition temperature) 라고 한다. Tg 이상으로 계속 온도가 올라가면 액상이 되게 되는데 이때의 온도를 Tm(melting temperature)라고 한다. 녹는 현상은 결정체가 규칙적인 배열을 갖고 있을때만 일어난다. 즉 amorphous 영역은 Tm이 존재하지 않는다. 반대로 crystalline 영역에서는 Tg가 거의 나타나지 않는다.

amorphous 영역을 가열하면 Tg에서 한 번 volume의 급격한 증가를 지나 rubber, gum, liquid까지 gradual 적인 transition을 보인다. 반면 crystalline 영역을 가열하면 glass상태가 점차 flexible해지며 Tm 이후에 liquid 상태로 변화하게 된다. thermoplastic(열가소성) 이란 열을 가하면 유연하게 변하는 성질을 뜻한다. 고분자는 일정 온도(Tg) 이상이 되면 thermoplastic 성질을 갖게된다.

한편 깁스 프리 에너지의 열역학적 기본 식 dG=Vdp-Sdt를 보자. 일정한 온도에서 G를 P(압력)에 대해 편미분 하게 되면 V(부피) 가 나오게 된다. 일정한 압력에서 G를 T(온도)에 대해 편미분 하게 되면 -S(엔트로피) 가 나온다. 압력과 온도로 편미분 한 결과를 한 번 더 온도에 대해 편미분 하게 되면 각각 부피팽창률(coefficient of expansion)과 부피의 곱, Cp(등압 열용량)을 -T로 나눈 값이 나오게 된다.

n차 전이의 정의는 깁스 플이 에너지의 n차 미분값이 불연속이 되는 지점을 뜻한다. 여기서 깁스 프리 에너지의 1차 미분으로 표현되는 V와 S는 1차 전이 온도에서 불연속적으로 변하게 된다. 깁스 프리 에너지의 2차 미분으로 표현되는 Cp와 α는 2차 전이 온도에서 불연속적으로 변하게 된다. Tm(녹는점)은 항상 1차 전이 온도이고 Tg(유리 전이 온도)는 항상 2차 전이 온도이다. 따라서 Tm과 Tg에서 polymer의 성질 값들의 변화는 다음 그래프와 같다.

수학적으로 해석해보면 V와 S는 2차 전이 온도에서 그래프의 기울기가 변화해야 한다. V와 S의 T에 대한 도함수인 α와 Cp가 2차 전이 온도에서 불연속인 것을 생각하면, 적분한 원래 함수에서 기울기가 달라지는 것은 당연하다. 위의 그래프에는 나와있지 않지만 2차 전이에서 불연속적인 α와 Cp는 1차 전이 온도에서 람다전이(λ-transition)이 나타나게 된다. 1차 전이 온도에서 미세 온도의 변화가 없어도 α와 Cp의 적분값인 V와 S의 값이 커지기 때문에 역시 수학적으로 해석하면 순간적으로 α와 Cp의 값이 무한대로 커졌다가 감소해야 한다.

Tg(유리 전이 온도)는 물질의 형태나 치환기에 따라서 변화한다. Tg와 polymer의 flexibillity는 밀접한 관계가 있다. flexible하다는 것은 고분자가 쉽게 회전할 수 있다는 것을 뜻한다. flexible한 polymer은 대체적으로 Tg의 값이 낮다. 아래 그림에서 치환기로 CH3(methyl group)과 C6H5(Penyl group)이 달려 있는 경우를 생각해보자. 벤젠이 달려있는 고분자는 메틸이 달려있는 고분자에 비해 상대적으로 더 회전하기 어려울 것이고, 더 높은 Tg값을 갖을 것이다.

대부분의 고분자들은 고체의 성질인 탄성과 액체의 성질인 점성을 동시에 가지고 있는 viscoelastic(점탄성) 물질이다.
온도 범위에 따라 고분자는 특정한 성질을 나타내게 된다. elastomer(탄성체)란 Tg와 Tm 사이 온도범위에 있는 polymer을 뜻한다. 탄성체 성질은 branch가 적거나 crosslink가 적은 polymer에서 잘 나타난다.
깁스 프리 에너지의 변화로 고분자가 탄성채인 이유를 열역학적으로 해석할 수 있다. H(엔탈피)는 분자 사이의 interaction과 관련이 있기 때문에 고분자가 Tension이 되어도 거의 값이 변하지 않는다. S(엔트로피)의 경우 polymer가 release 되면 bond length, tortion angle, valance angle의 많은 경우의 수를 가질 수 있어 엔트로피의 값이 높다. 그러나 tenison이 되었을 때 기존에 불규칙적인 배열이 stretched 되기 때문에 엔트로피의 값이 낮아지게 된다. 따라서 G값은 Tension이 되는 경우에 더 낮아지게 되고, polymer가 탄성력을 갖게 된다.

몇몇 polymer들은 너무 rigid해서 flexible한 필름을 만들 때 사용하기 적절치 않다. 이때 volatility 값이 낮은 액체물질을 넣어주는데 이 물질을 plasticizer(가소제) 라고 한다.
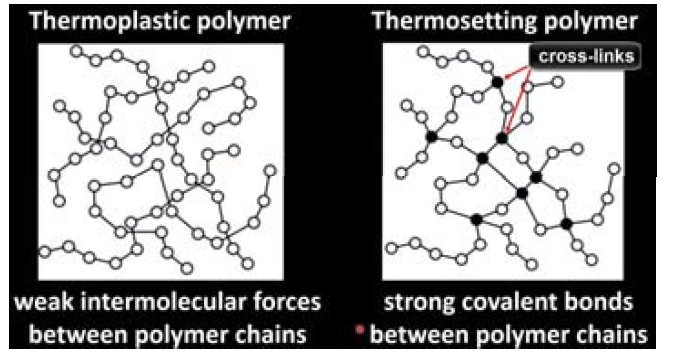
thermosetting(열 가소성)은 thermoplastic과 반대대는 성질로, 열을 받으면 고체화되어 가교된 매트릭스를 형성하는 것을 뜻한다. 주로 highly crosslinked matrix polymer에서 나타나는 성질이다. epoxy resine이 대표적인 예시이다. 아래 그림을 보면 thermoplastic과 thermosetting간의 차이가 잘 나타나 있다. thermoplastic의 경우 엉켜있는 고분자 사이에는 단지 약한 반데르발스 힘만 작용한다. 반면 thermosetting의 경우 crosslink가 일어나 엉켜있는 고분자 사이에 강한 covalent 결합이 존재해 열,용매,물리적인 충는 에 강한 특성을 보인다.
'polymer chemistry' 카테고리의 다른 글
| introduction of polymer chemistry (2) (0) | 2019.06.30 |
|---|---|
| introduction of polymer chemistry (1) (0) | 2019.06.30 |
| free radical polymerization -개요 (0) | 2019.06.30 |




 <supramolecular 예시, 공유결합이 아닌 수소결합에 주목>
<supramolecular 예시, 공유결합이 아닌 수소결합에 주목>