자유라디칼중합은 말 그대로 라디칼이 참여하는 polymerization 과정이다.
성장하는 chain의 끝부분에 라디칼이 만들어지고, 다른 monomer을 공격하면서 chain이 성장한다.
주로 이중결합(alkene)을 가지고 있는 monomer에서 일어나는 중합과정이다.
대표적인 예로 PS(poly styrene), PVC(poly vinyl chloride)등이 있다.
중합과정은 크게 4단계로 나누어진다.
1. initiation : active center(라디칼)이 만들어지는 과정
2. propagation: 라디칼이 옮겨가면서 monomer이 chain에 더해지는 과정
3. chain transfer: active site가 monomer이 아닌 다른 분자로 이동, dead radical이 되고 propagation 과정이 멈춘다.
4. termination: 두개의 chain active center가 만나 결합된다.

initiation 과정에은 두 단계로 나누어져 있다.
(1) 라디칼의 형성 (주로 initiator로부터)
(2) monomer radical의 형성(chain initiaion)
먼저 라디칼의 형성 과정부터 살펴보자.
라디칼 중합이 이루어지기 위해서는 먼저 라디칼의 형성 단계가 필요하다.
라디칼의 형성에는 두 가지 방법이 있다.
(1) monomer 자체가 열이나 빛을 받아 쪼개짐
(2) initiator 이 분해되어 라디칼 형성 (일반적) , 위의 그림에서 (1)initiation의 첫 번째 과정
자주 사용되는 initiaor로는 BPO, AIBN, persulfate 등이 있다.
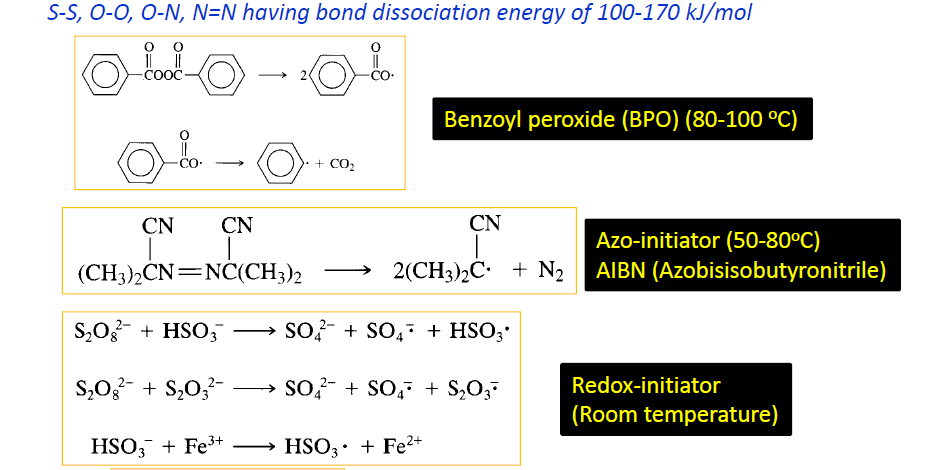
BPO의 경우 적당히 예민해서 (AIBN에 비해 높은 온도에서 peroxide 결합이 분해됨) 자주 사용되낟.
persulfate(S2O8)은 redox initiator의 일종이며 물에 녹는 수용성이다. 따라서 에멀젼 중합에서 사용될 수 있다.
이 외에도 광분해, 방사성 분해 등으로 radical을 형성할 수 있다.
한편 radical이 만들어졌다고 해서 polymerization 과정 중 하나인 chain initiation(radical이 monomer과 반응해 monomer radical이 생성됨. 앞서 나온 initiation 과정 중 두번째 과정)이 일어나는 것이 아니다.

생성된 라디칼은 solvent cage 내에서 다시 다른 라디칼과 결합할 수 있다. 이것을 primary recombination이라 한다. 라디칼이 solvent cage 밖으로 나와 다른 라디칼과 결합할 수도 있다. 이것을 secondary recombination이라 한다. 이 외에도 polymer radical, initiator radical, solvent 등과 결합할 수 있다. 위 그림에서 맨 마지막에 해당하는 과정이 monomer과 결합해 monomer radical을 형성하는 chain initiation 과정이다.
그렇다면 initiaor의 효율을 최대로 높이기 위해선 어떻게 해야 할까. 우선 상대적으로 낮은 온도가 유리하다. 그 이유는 반응 속도가 작기 때문에 형성되는 radical의 양이 적게 되고, recombination이 일어날 가능성이 줄어든다. 두 번째는 monomer 농도에 비해 작은 radical의 농도이다. 이 경우 성공적인 chain initiation 확률을 높혀준다. 동일한 monomer 농도에서 initiator 양을 적게 넣어줌으로써 생성되는 고분자 분자량을 더 높게 조절할 수 있다.
일단 monomer radical이 형성되면 다른 monomer들이 결합하면서 빠르게 polymer chain이 성장한다. 아래 그림에서 polymer chain이 monomer와 결합하는 경우를 보자. 메커니즘적으로 살펴보면 라디칼은 두개의 탄소 중 하나를 공격해서 monomer의 이중결합을 푼다. 치환기가 달려있는 탄소를 head라 하고 달려있지 않은 탄소를 tail이라 한다.

대부분의 라디칼 합성은 head to tail reaction으로 이루어진다. head to head 반응과 tail to tail 반응은 kinetic 등을 계산하는 과정에서 무시할 수 있다. head to tail addition이 더 유리한 이유는 steric 효과 때문이다. 치환기가 달려있는 head 탄소는 상대적으로 bulky 하기 때문에 라디칼이 들어와서 공격하기 어렵다. 또 다른 이유는 resonance(mesomeric) 효과 때문이다. tail 쪽 탄소를 공격하면 head 부분에 라디칼이 형성되고, 이때 달려있는 치환기가 라디칼을 delocalization 하는 효과가 있어서 더 안정하다.
termination 단계에서는 만들어진 polymer chain끼리 결합해서 radical이 사라지게 된다. termination의 가능한 경우 역시 coupling(combination)과 disproportionation 두 가지가 있다. coupling은 두 polymer chain radical이 만나서 head to head 로 결합하며 라디칼이 소멸되는 경우이다. 두 chain의 중합도가 x,y라고 했을 때 완성된 polymer의 중합도는 x+y이다. disproportionation은 전자의 불균등 분배이다. 한 chain이 수소 라디칼을 제공하면서 두개의 polymer chain이 형성된다. 완성된 polymer의 중합도는 각각 x와 y이다.

아레니우스 식을 통해 주어진 온도에서 combination과 disproportionation의 비율을 구할 수 있다. 일반적으로 disproportionation의 활성화 에너지가 더 높기 때문에 combination이 주로 일어난다.

아래 표를 보면 monomer의 종류에 따라 combination과 disproportionation의 비율이 다른 것을 알 수 있다.

그 이유는 termination 과정이 monomer의 구조에 영향을 받기 때문이다. head 부분에 치환기가 bulky 하다면 head to haed로 일어나는 coupling이 일어나기 힘들다. 위의 표에 나타나는 methyl methacrylate와 vinyl acetate의 coupling 비율이 적은 이유이다. disproportionation 과정은 penultimate(끝에서 두 번째) 탄소에서 H를 때어내면서 일어난다.

마지막으로 chain transfer 과정을 살펴보자. 이 과정은 polymerization에서 우리가 원하는 반응이 아닌 side reaction이다. 원래대로라면 radical이 monomer을 공격해야 하지만 용매, 불순물 등을 공격해 라디칼이 소멸되게 된다. 이상적인 polymerization 과정에 비해 분자량이 작게 나타나는 원인이 된다.

한편 polymer이 너무 과도하게 성장하는 것을 막기 위해 일부러 chain transfer 물질을 넣어주는 경우가 있다. 이때 옮겨간 라디칼의 반응성에 따라 inhibitor(금지제)와 retarder(지연제)로 구분지을 수 있다. inhibitor은 생성된 라디칼이 아예 monomer에 대해 반응성이 없는 경우이다. retarder은 생성된 라디칼이 normal radical에 비해 반응성이 작은 경우이다.

'polymer chemistry' 카테고리의 다른 글
| thermophysical property of polymer (고분자의 열역학적 성질) (1) | 2019.07.01 |
|---|---|
| introduction of polymer chemistry (2) (0) | 2019.06.30 |
| introduction of polymer chemistry (1) (0) | 2019.06.30 |