- monomer: polymerization이 가능한 분자. polymer의 반복적인 구성 요소가 된다. 아래 그림에서 ethylene과 amino acid 분자가 해당된다.

- polymer: macromolecule, 하나 혹은 여러개의 monomer 들이 길게 이어져 만들어진 분자. 각각의 monomer들은 primary covalent bonding으로 이어져 있다.
- supramolecular: polymer은 covalent bonding으로 이루어진 반면 supramolecular의 구성요소는 non covalent bonding으로 이루어져 있다. polymer 처럼 분자량과 분자크기가 거대하며 polymer과 비슷한 성질을 나타낸다.
 <supramolecular 예시, 공유결합이 아닌 수소결합에 주목>
<supramolecular 예시, 공유결합이 아닌 수소결합에 주목> - oligomer: low molecular weight polymerization product. 구성하는 monomer의 수가 polymer에 비해 훨씬 작다. 예시로는 monomer이 2개, 3개, 4개 결합된 dimer, trimer, tetramer 등이 있다.
oligomer과 polymer은 분자의 성질로도 구분이 가능하다. polymer은 분자량이 10000~20000 이상이며, 반복단위가 1000~2000번 이상인 분자를 뜻한다. 작은 분자량 수준에서는 분자량이 증가할수록, 즉 반복단위가 늘어날 수록 molecular property가 변화한다. 하지만 분자량이 10000~20000 이상이 되면 더 이상 분자량의 증가에 따른 property의 변화가 나타나지 않는다. 이를 saturated 되었다고 하고, 이 때를 polymer 의 기준으로 삼을 수 있다.


같은 분자량을 가진 polymer이라도 그 형태에 따라 다른 성질을 나타낸다.
- Linear polymer: 직선 형태의 polymer, PVC, PMMA, nylon 66 등이 해당된다.
- Branched polymer: 불규칙한 간격으로 barnch가 있는 polymer. branch가 적은 polymer은 dissolution 될 수 있다. 그러나 branch 의 수가 늘어나면 dissolution이 아닌 swelling(팽윤 현상)이 일어난다.
- network(crosslinked) polymer: branch가 이어져서 복잡한 network를 형성한 polymer이다. chain 사이에 chemical linkage가 존재한다. crosslink가 적은 경우 flexible한 elastomer(탄성체)가 되며 crosslink가 많아지면 rigid해지고 thermosetting(열경화성) 성질을 갖게 된다. crosslink polymer 역시 dissolution이 아닌 swelling이 주로 일어난다.
여담으로 nylon 66 이름의 명명법을 알아보자. 처음 나오는 숫자 6은 amine group에 존재하는 탄소의 수를 뜻한다. 나중에 나오는 숫자 6은 carboxyl group에 존재하는 탄소의 수를 뜻한다. 같은 방식으로 nylon 6 10은 amine group에 6개의 탄소가, carboxyl group에 10개의 탄소가 존재한다.

PMMA (poly methyl methacetlyate)의 경우에 첫번째 M, methyl은 O(산소)와 연결된 methyl기(아래 그림에서 오른쪽 methyl기)를 뜻한다. 두번째 M, metha는 이중결합 탄소에 직접 연결된 methyl기(아래 그림에서 왼쪽 methyl기)를 뜻한다.


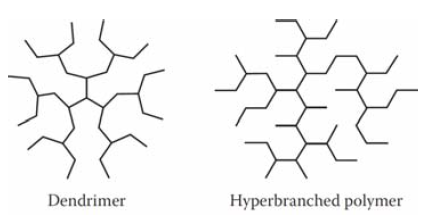
- Star polymer: 중심으로부터 radiating(방사)를 가진 polymer. multicore로부터 arms를 polymerization 하거나, 미리 만든 polymer arms를 core에 붙혀서 만든다.
- Dendrimer: 규칙적인 branch를 가지고 있는 polymer. 3차원 구 구조이다. kinetic control이 힘들다.
dendrimer의 구 구조 때문에 bulk 나 solution 에 존재할 경우 polymer 사이의 entanglment를 억제해 viscosity가 기대했던 값 보다 작게 나오게 된다.
- hyperbranched polymer= dendron: 한 방향으로만 자란 dendrimer polymer.
'polymer chemistry' 카테고리의 다른 글
| thermophysical property of polymer (고분자의 열역학적 성질) (1) | 2019.07.01 |
|---|---|
| introduction of polymer chemistry (2) (0) | 2019.06.30 |
| free radical polymerization -개요 (0) | 2019.06.30 |